E peptidi sò una classa di cumposti furmate da a cunnessione di multiple amino amino attraversu i ligami di peptide. Sò ubiquitius in organismi viventi. Finu à avà, decine di millaie di petidi sò stati truvati in organismi viventi. Perpedi Play Un rughjunariu impurtante en Regulà à attività funziunali di diversi sistemi, organi, calienti è in attività di vita, è sò spessu usati in u sviluppu funziunale è altri campi. Cù u sviluppu di a tecnulugia di cuscinologia di biotecnologia è di e pettiche di e peptide, più è più peptide sò stati sviluppati è applicati in clinica.
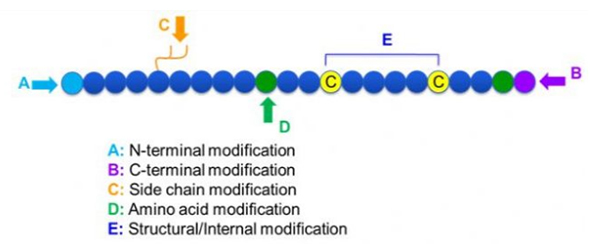
Ci sò una larga varietà di pulitificazione di peptide, chì pò esse simpricamente divisi in mudificazione di mudificazione è aduprendu deriva, mudificazione di a chiarma, etc., dipinti di u situ di mudificazione (Figura 1). Cum'è un modu impurtante di cambià a struttura di catena principale o fire à u pecurianu di effetti prezzi di a tempu, chì face l'effetti biologi, eliminate l'actualità pettine, eliminà stu articulu strategie di mudificazione maiò è e so carattere sò introdutta.
1. CICCOLAZIONE
Petti ciclichi anu parechje applicazioni in biomedicine, è assai peptidi naturali cù l'attività biologica sò peptidi ciclici. Perchè i petti ciclici tendenu à esse più rigidu chì i pepear si sò resistenti à u sistema digeritu, ponu sopravenuvà in u trattu digestivo, è l'esposizione una affittu più forte di i recepti più forti. Ciculi Hè u Via più attraente à Sintesi Per Peccelli ciclici, in particulare per Pepoidi cù grande schetore strutturale. Sicondu u modalità cicciarizazione, pò esse divisa u tippu di catena di catena laterale - u tippu di a catena laterale, u terminal - TIPO terminale (fine di a fine di a fine).
(1) Lidechain-to-Sidechain
U tippu più cumunu di a catena latia à a ciclista di a catena laterale hè di rimpiazzà di i residui di u ciisinu. Questa ciclea hè introdutta un paru di residui cysteine si depostavanu è dopu ombre per formà bonds disulfsi. A sintesi policlica pò esse ottenuta da eliminazione selettiva di i gruppi di prutezzione di u sulfuru. Ciccirizazione pò esse fatta in un solvente post-dissocezione o in una resina di pre-dissociazione. Ciciclista per i resine pò esse menu efficace chì a ciclismo solvente perchè e pepettivi nantu à i resine ùn anu micca ragiunate cunfurmità. Un altru tipu di ciain - cripu riva di a ciadiu è a impresa d'acidu asparica è u gruppu di punti di gloria è di a pulizza o dopu dissimentu. U terzu tipu di catena side - Cecione di a Catena Side hè a Formazione di Diphenil Ethers per tyrosine o p-hydroxyfenillique. Stu tipu di ciclale in prudutti naturali hè solu truvatu in prudutti microbiali, è prudutti ciclaghjiche spessu anu u valore medico potenziale. A preparazione di questi composti necessitanu cundizioni di reazione unica, per quessa ùn sò micca spessu usati in a sintesi di peptidi convenzionali.

(2) terminal-to-sidechain
A ciccirizazione di a catena di u terminal implica u terminal C di l'amino di a catena di lysine o ornitina, o u terminal cun l'acidu di l'acidu asparticu. L'altra ciclista poliiceptide hè fatta da furmà beni d'etere trà C è Serine Terminal o Licea laterale.
(3) Tipu di terminal o di testa
Chain Policeptides ponu esse cicciati in un solvente o fissatu nantu à una resina à a cicculata di a catena laterale. A bassu cuncentrazione di petidi anu da esse usati in a centralizazione di a solvente per evità l'ostacomerizazione di peptidi. U rendimentu di una polipeptida di u sonu di a testa à a cuda dipende da a sequenza di a police di a catena. Dunque, prima di spettanu à Pettiche ciclicu, una libreria di esse pussutu riesce ripigliatu per u ciclista per truvà a sequenza cù i migliori risultati.
2. N-metilazione
N-metilazione hè originalmente in i peptieri naturali è sò introduttu in sintesi di peptide per prevene a furmazione di i ligami di idrogenu, dunque fà peptidi più resistenti à u biodegradation in a liberazione. A sintesi di pepetti usendu a derivazione di l'amino amino methilated hè u metudu più impurtante. Inoltre, ritenimentu Mitsunobu di N- (2-Nitrobenzen Clorside di Sulfonia) Polspepettide-Resin Intermediate cù Methanol pò ancu esse usatu. Stu metudu hè statu usatu per preparà e librerie cicliche chì cuntenenu l'amino amino di u metilatu.
3. Fosforilazione
A fosforilazione hè una di e modificazioni post-manifestazione più cumune in natura. In e cellule umane, più di u 30% di e proteine sò fosforilati. Fospolilazione di fosforilazione, chì face un rolu impurtante, guadagnà un rolu impurtante per cuntrullà parechji prucali cellulari, espressione di u ciclismo è apoposisia.
A fosforylazione pò esse osservata in una varietà di eiutati d'amèmoite d'l'acide, ma i mibi di fosfierreelazione più cumuni sò servine, thremone, è residi è tirosine è tirosine è tirosine è tirosine è residi. Fosfotrosia, fosfotreonine, è i derivati di fosfoserina ponu esse introduttu in Perpettivi durante sintesi o furmati dopu a sintesi di peptide. A fosforilazione selettiva pò esse ottenuta usendu risità di serine, tholconine, è tirosin chì piglianu selettivamente gruppi. Alcune reagenti di fosforilazione ponu ancu introducire i gruppi di l'acidu fosforti in u polipeptide per mudificazione di post. In l'ultimi anni, a fosforilazione di u situ hè statu ottenutu u realizatu utilizendu una reazione di fostigrava chimicamente selezzione-figura (Figura 3).

4. MySotoyLazione è palmitocativa
L'acilazione di u terminal di N-terminale cù l'acidi grassi permette di peptidi o proteine per ligà à i membrani cellulari. A sequenza di u mridamoylated nantu à u Terminal Per Src Famiglia di Famiglia Proteine è Proteine GAQ di GAINS REVERSTREST per esse destinati à abilità à i membrani cellulari. A l'acidu misticu hè stata ligata à u Terminale N-Terminu di a Polsoptide di a Resina, cù l'accessu standard, è a Lipopepetta standard puderia esse dissciatu sott'à cundizzioni è purificate da RP-HPLC.
5. Glycosylation
GLYCOPTIDES COME VANCOMIANI E TEICOLANIN sò l'antibiotici impurtanti per l'infizzioni bacteriani resistenti à a droga, è altri glycopuptides sò spessu usati per stimulà u sistema immune. Inoltre, dapoi parechji antigens microbiali sò glycosilatu, hè di grande impurtanza per studià glycopettire di migliurà l'effettu terapeuticu di l'infpiciente. Per d 'altra banda, hè stata trovata chì a membrana di a celluna di i celluli cellulari Exhissi animariu animanu U GLYCOPTIDE sò preparati da fmoc / t-bu. Residui gldrosilatati, cum'è Merintoqued, sò spessu introdutti in polpiptides di Pentaflipides per Pentafliflorophenol asiestici attivi da prutege i fmino attivati
6. Isoprene
Isopenzadienilazione si trova nantu à i residui di u ciisinu in a catena laterale vicinu à u terminal C. A proteina isoprene pò migliurà a affinità di a membrana è a forma di proteine di proteine. A prutezioni Isopentadienate includenu tyrosine fosfatase, motte di codaperone, mamole cochaperone, lamina nuclea, è centrommerica di e proteine. I poletti isoprene ponu esse preparati utilizendu isoprene nantu à i resine o introducendu e derivati interiali.
7. Modificazione di Gyletilene (Peg)
Modificazione di PEG pò esse usatu per migliurà a stabilità idrolitica di proteina, biodistribuzione è u solubilitariu peptido. L'intruciazione di e catene PEG pò mustrà e so proprietà farmaciculari è ancu inibitale di l'idrolisi di l'eppide di pruteoliticu. Pettelli PEG passanu per mezu di a sezione di croce capillaria glomerulare più facilmente da peptidi ordinarii, riduzzione di renali fantastica. A causa di a meza vita estesa di peptidi in vivo, u livellu di trattamentu nurmale pò esse mantinutu cù dosi più bassi è menu frequenti di pettine. Eppuru, Modificazione di PEG hà ancu effetti negativi. Grandi quantità di peggiu impediscenu chì l'enzima di degradà u peptide è reduce ancu u fegatu di a peptida à u receptore di destinazione. Ma a mala affinità di u Peg Pegsdi hè di solitu a mità di a mità di u so farmacokineticu, è per esse presente in u corpu più longu, i peptidi di u Peg anu una probabilità più grande di esse assorbita in i tessuti di destinazione. Dunque, specificazioni poliimer di peeg deve esse ottimizzati per i risultati ottimali. Per l'altra parte, Peplidi di Peg accumulate in u fegatu per a liberazione renale ridutta, risultatu in u sindrome di macromolecular. Dunque, modifiche di peb anu bisognu à esse cuncepitu cù più cura quandu e peptidi sò aduprate per a prova di droga.

Gruppi di mudificazione cumuni di Modificatori di Pegs pò esse riassuntu cum'è seguitu: Amino) -Nh2, aminomethyl-ch2-nh2-cooh, Sulbozide -Melate -sh, Sucrinimide Autonici -spa, N-Hymroxysuccinimide -nhs, acrilate-ch2ch2cooh, ALDEHYDE-ALD, BUTICULATO-ACRL), FUGLOOGE, ACRL), arrilati (-Llownl -abru), assrelate in inglese, assrelate-alkyne, P-toluenesulfonate -ots, Succinimide Succinate -ss, ETC. I Derivati di Pug cù l'acidi carboxici ponu esse accoppiati à l'ami di u Terminale N -ine o LYINE. U Peg Amino-Activatu pò esse accumpagnatu à l'acidu asparticu o di e catene laterali di l'acidu glutamicu. U peg di Mal-attivatu pò esse cunjugatu à u Mercapu di Catene laterale di i cestini di deputatu [11]. I modificatori di pugs sò solu classificati cum'è u seguente (nota: MPEG hè Methoxy-Peg, Ch3o- (ch2ch2o) N-Ch2ch2-Oh):
(1) Modificatore di Peg Dritta
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-sh, MPEG-ALD, MPEG-Buttyrald, MPeg-Buttyrald, MPeg-SS
(2) Modificatore di Peg Bifunctional
Hcoo-Peg-Cooh, NH2-Peg-NH2, Oh-Peg-Cooh, Oh-Peg-NH2, HCL · Peg-Booh, Mal-Peg-NHS
(3) U modificatore di branchchite
(MPEG) 2-NHS, (MPEG) 2-Ald, (MPEG) 2-NH2, (MPEG) 2-Mal
8. BioTinizazione
U biotin pò esse ligatu cù Avidin o Streptatidin, è a forza di ligame hè ancu vicinu à u ligame sfidante. U pepettivi di i petivi di biotin sò cumunimenti utilizati in Immpuhassay, HistocyToThimmistry è u fluoruorità di u flussu di u flussu di flussu. Etichettate antibiotini etichettate ponu ancu esse usati per lavà e peptidi biotinilate. I etichette di i biotin sò spessu attaccati à a catena laterale lisia o u terminal n. ACID 6-AminoCoProom hè spessu usata cum'è un ligame trà peptidi è biotin. U Bond hè flexible in ligame à u sustrato è i bindi megliu in a presenza di l'ostaculu stericu.
9. L'etichettatura fluorescente
L'etichettatura fluorescente pò esse usata per traccia polettidi in e cellule di vita è di studià enzimi è miccanismi d'azzione. Triptofanu (trp) hè fluorescente, cusì pò esse adupratu per l'etichettatura intrinsica. U spettru di l'emissione di u triptofanu dipende da u ambiente perifericu è diminuite a polarità solvente, una prupietà chì hè utile per rilevendu a struttura di peptida. A fluorescenza di u triptofanu pò esse sbulicatu da l'acidu asparticu protettatu è l'acidu glutamicu, chì pò limità u so usu. U Gruppu Dansil Cloidio (Dansilo) hè assai fluorescente quandu hè ligatu à un gruppu Amino è hè spessu usatu cum'è etichetta fluorescente per Amino Accoids o Proteine.
A cunversione di l'energia di ripresa di ripresa di u fluoriscenza (fret) hè utile per i studii enzili. Quandu u fret hè applicatu, u polipeptid di u sustrato di solitu cuntene un gruppu di etichettatura di fluororescenza è un gruppu di quinching di fluorescenza. I gruppi di fluoriscenti marcati sò affundati da u quenchs attraversu u trasferimentu energeticu non foton. Quandu u peptide hè dissociatu da l'enzima in quistione, l'etichettatura emette fluorescenza.
10. Cage PolicePtides
U Papidi di Cage anu otticemente gruppi protettivi di removable chì scudianu u peptido di ligame à u receptore. Quandu esposti à a radiazione UV, a peptida hè attivata, restituisce a so affinità à u receptore. Perchè questa attivazione ottica pò esse cuntrullata secondu u tempu, amplitude, o locu, i peptidi di cage pò esse usatu per studià e reazzioni chì si trovanu in e cellule. I gruppi di prutezzione pruticavanu per u gruppi di polipeppi di a Carage è i so derivici, chì ponu esse introdutti in sintesi Poputi via di a cintesi di Peptide Attivanu. Derivazione di l'arte Aminomente chì sò stati sviluppati sò lyseine, ksteine, serine è tirosine. Derivattii aspartati è glutamate, però, ùn sò micca cumunimenti usati per via di a so scepcepimentu à a ciclisazione durante a sintesi è dissociazione.
11. Populique (Map)
I petidi corti ùn sò generalmente micca immune è deve esse accumpagnatu à e proteine di traspurtadore per pruduce antibodies. Peteanu (Map) hè cumpostu da parechji Pepoids identici in Multipy à Lysine Nuclei, chì pò sprimà l'alba di potenza Immunogeni è pò esse usati per appassià i salpetti di potà. I polisi di carte pò esse sintetizzati da sintesi di fasi solidu nantu à a resina di a mappa. Tuttavia, incomplete i risultati di coupling in e catene di peptide mancanti o truncati nantu à qualchi rame è cusì ùn mostra micca e proprietà di a cartografia originale. Cum'è una alternativa, i pepoidi ponu esse preparate è purificate separatamente è dopu accoppiatu à a mappa. A pupulazione di peptide attaccanu à u Codice di Petid hè ben definitu è facilmente carattarizatu da spettrometria di massa.
Cunclusione
A mudificazione di peptide hè un mezzu impurtante di cuncepisce peptidi. E pezzi modificati ùn ponu micca solu mantene una alta attività biologica, ma ancu evitendu effittivamenti di l'immunogenicità è tossicità. À u stessu tempu, a mudificazione chimica pò finisce peptidi cù alcune novi proprietà eccellenti. In l'annati recenti, u metudu di l'attivazione di C-h per a post-mudificazione di polpialmente hè stata sviluppata rapidamente, è parechji risultati sò ottenuenu.
Tempu post: 2025-07-03
